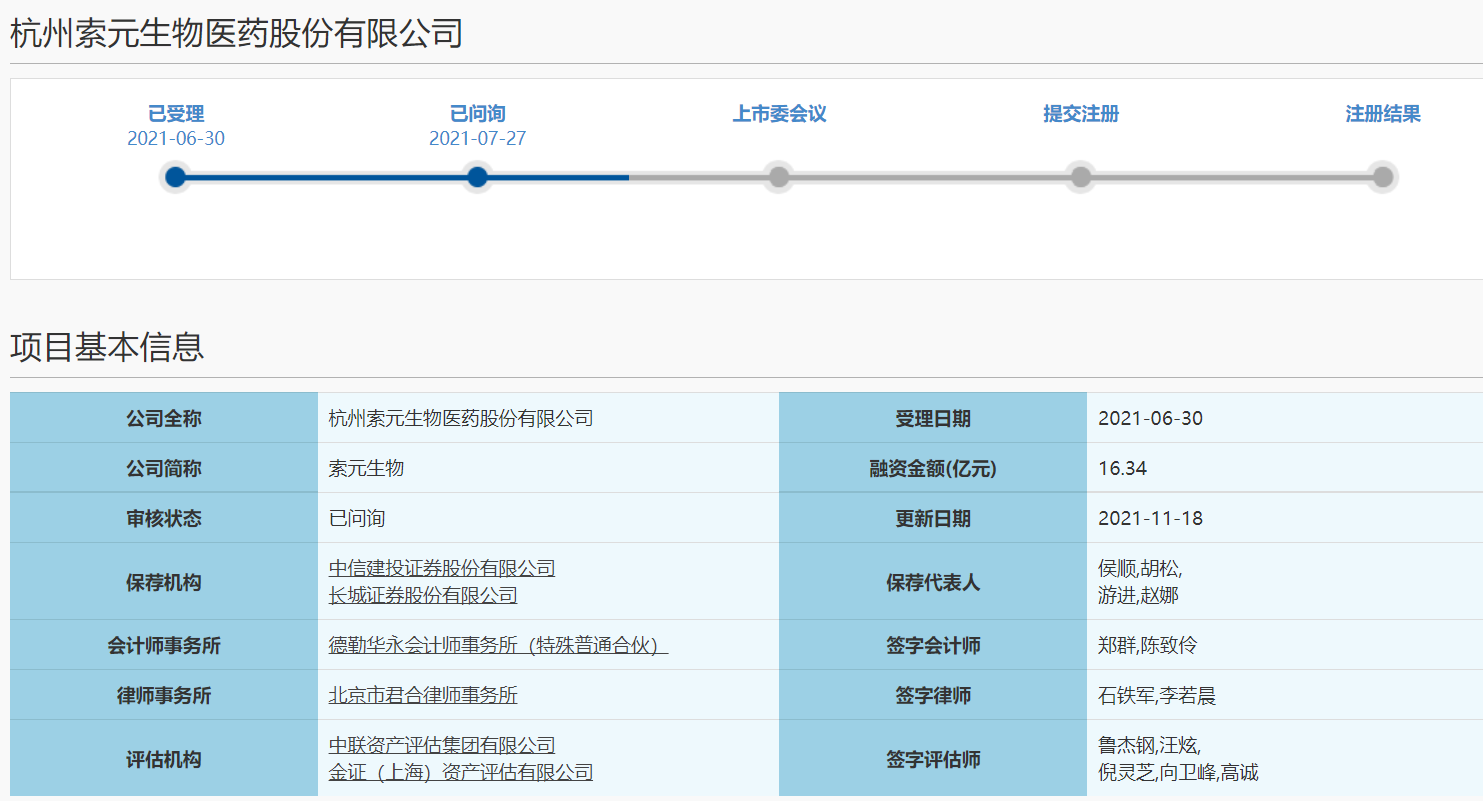
一劑需要210萬美元,曾被業界譽為“史上最貴藥物”的Zolgensma,僅僅在獲批兩個月之后,就遭遇了大麻煩。
根據美國食藥監局(FDA)8月6日發布聲明稱,諾華最近獲批的基因療法——Zolgensma存在部分臨床前“數據操縱”(data manipulation)一事。
Zolgensma是用于治療2歲以下,在兩個編碼運動神經元生存蛋白(SMN)的SMN1等位基因上攜帶突變的脊髓性肌萎縮癥(SMA)患者。今年5月24日剛剛被FDA批準上市。因定價高達210萬美元被稱為“全球最昂貴藥物”。
FDA在聲明中稱,上述產品上市后,其研發公司AveXis Inc.(諾華子公司)主動通知FDA,Zolgensma療法可能存在部分數據處理問題,可能影響生物制劑許可證申請中提交的動物產品測試中某些數據的準確性。
對此,FDA表示,可能會對諾華公司提起訴訟。
諾華在今天對此事的回應中稱,對Zolgensma的安全性,質量和功效充滿信心。
而此次涉事的Zolgensma,為諾華在2018年4月通過以87億美元收購AveXis獲得。此前市場預估,到2024年,其銷售額可超過15億美元。
截止目前,Zolgensma尚未在中國上市。
數據操縱 諾華或面臨刑事或民事處罰
根據FDA聲明,Zolgensma獲批上市后,6月28日,AveXis向FDA披露,該基因療法存在部分數據操縱的問題,影響到在生物制劑許可證申請(BLA)中提交并經FDA審查的動物產品測試中的某些數據的準確性。
上述被操縱的數據來自一項動物實驗,該實驗比較了兩種Zolgensma的版本,一種在第一階段研究,另一種在第三階段測試。而被操縱的Zolgensma數據僅限于支持生產過程的“產品測試數據”。
根據相關報道,FDA專員Ned Sharpless表示,“我們依靠真實的科學數據來做出監管決定,我們非常重視數據的完整性問題”,“在這種情況下,如果適當,該機構將利用其全部權力采取行動,其中可能包括民事或刑事處罰。”
而另據FDA生物制品評價和研究中心主任Peter Marks介紹,FDA正在仔細審查在生產過程中使用的產品測試數據的操縱問題,并正在對最近完成的一次檢查的信息進行全面評估,以評判是否需要采取進一步的措施。
諾華在今天的公開回應中稱,不準確的數據僅占整體提交數據的一小部分,并且僅限于初始產品測試,并不是用于目前已上市產品。
在強調Zolgensma療法安全性和有效性系確切的同時,諾華還表示,公司完全有能力向有需要的患者釋放高質量,完全合規的Zolgensma,并將繼續與FDA密切合作,以適當更新其提交并解決所發現的任何質量差距。
諾華預計此次事件不會影響正在進行的Zolgensma監管備案和發展計劃的時間安排。
AveXis也將采取適當行動,以防止未來發生在其開發計劃組合中的事件。
推遲報告 諾華內部合規問題受質疑
雖然是主動報道,但卻不是及時報告。
事實上,按照FDA負責審查諾華基因療法的部門主管Wilson Bryan博士的說法,AveXis早在3月初就已經知道存在數據篡改行為。之所以等到6月才通知FDA,主要是因為如果FDA此前知道了這種數據操縱行為,就會推遲Zolgensma的獲批上市。
這也被認為是FDA大為惱火的原因。
不過這一披露不會影響對該公司人體臨床試驗數據的“積極評估”。Bryan表示,“根據目前的信息,三期臨床試驗結果繼續為Zolgensma的有效性提供強有力的證據,同時也提供了足夠的安全性證據,以支持總體有利的利益-風險分析。”FDA目前對于保留Zolgensma的上市資格仍持有信心。
盡管如此,結合在各國被曝光的多起商業賄賂案,以及2013年以來,日本藥品監管部門發現的操縱數據、瞞報藥物副作用等丑聞,業界認為,諾華內部合規問題仍然需要進一步規范。